Bệnh Tụ Huyết Trùng Thể Bại Huyết Trên Trâu, Bò
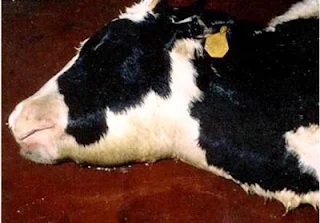 |
| Bò chết rất nhanh là dấu hiệu đầu tiên của bệnh. Ảnh minh họa. |
1. Căn bệnh và dịch tễ:
Carter và Bain (1960) và Carter (1982) nhấn mạnh sự nhầm lẫn và lạm dụng cách gọi tên bệnh do Pasteurella trên trâu bò. Do đó khó đánh giá chính xác nhiều báo cáo trước đây về bại xuất huyết. Bệnh nguyên phát thường do các serotyp 6:B (Châu Á) và 6:E (Châu Phi). Ơ một số nước nhất là Ai Cập và Sudan có cả 2 serotyp trên. Bệnh bại xuất huyết trâu bò là bệnh nguyên phát trong khi bệnh chuyên chở (shipping fever) thường là kế phát.
P. multocida có sức đề kháng không cao và không tồn tại lâu ở ngoài cơ thể thú. Trong đất và bùn do cạnh tranh với nhiều vi sinh vật khác, nó thường không tồn tại quá 24 giờ (Bain, 1963). Độc tố đã được chứng tỏ trong nước lọc canh trùng là loại nội độc tố bản chất polypeptid PM: 120 000-160 000, có vai trò trong gây bệnh lâm sàng và chết nhanh.
Nguồn bệnh chính là các thú mang trùng. Vi khuẩn ký sinh ở niêm mạc mũi hầu và tuyến hạnh nhân. Trên đàn thú đã từng xảy ra bệnh, có đến hơn 40% trâu bò có vẻ khỏe mạnh mang trùng, trong khi ở đàn không có bệnh thì tỷ lệ đó là 3,8%; 5,5% và âm tính (Mustafa và ctv, 1978). Ngoài ra tỷ lệ mang trùng ở trâu bò dưới 2 năm tuổi cao hơn ở trâu bò trưởng thành. Người ta ước lượng khoảng 10% thú mang trùng trở nên miễn dịch.
Bệnh lây lan do ăn thức ăn bị nhiễm. Vai trò của ngoại ký sinh cắn hoặc hút máu trong lay lan vẫn chưa được rõ mặc dù Macadam (1962) qua thí nghiệm trên thỏ chứng minh ve có thể truyền bệnh.
Thường người ta cho rằng các stress do ngoại cảnh là yếu tố quan trọng cho bệnh phát ra. Bệnh thường xảy ra khi thú bị lạnh và ướt, nhốt trong chuồng trại không thích hợp hoặc quá kiệt sức do cày kéo. Dưới các điều kiện trên, sức miễn dịch của thú giảm nên vi sinh vật sẽ nhân lên nhanh chóng trong thú mang trùng và bài xuất mầm bệnh lây lan cho thú mẫn cảm nếu có tiếp xúc. Vi khuẩn có rất nhiều trong chất tiết mũi và nước bọt ở thú có triệu chứng lâm sàng.
2. Triệu chứng:
Bệnh thể quá cấp gây chết rất nhanh với rất ít triệu chứng lâm sàng. Trong thể cấp tính, thú bệnh sốt đột ngột 41 - 42 độ C (106-108 đô F), rất mệt mỏi, phù thũng vùng hầu, chảy nhiều nước bọt và chết, thường không quá 24 giờ. Dạng phù thũng cũng cấp tính với sự tạo thành những chỗ sưng, nóng, đau ở đầu, họng, ngực, bao qui đầu và chân. Nếu đầu và họng bị phù thường sẽ gây thở khó và gây chết do ngạt thở hơn là bị bại huyết.
Đặc biệt trong những ngày nắng nóng, bệnh rất dễ xảy ra. (xem thêm: Hướng dẫn các biện pháp chống nóng cho bò, bò sữa)
Đặc biệt trong những ngày nắng nóng, bệnh rất dễ xảy ra. (xem thêm: Hướng dẫn các biện pháp chống nóng cho bò, bò sữa)
3. Bệnh tích:
Khám tử thi cho thấy nổi bật là các xuất huyết lấm tấm phân bố rộng khắp trên các màng niêm và nhiều cơ quan nội tạng nhất là phổi và cơ bắp, ở vùng họng có phù thũng dưới da. Phổi bị phù thũng, có thể cho thấy có dấu hiệu khởi đầu của viêm phổi gian bào (kẻ), viêm dạ dày-ruột xuất huyết. Trong thể bệnh phù thũng, nhiều vùng phù thũng ở đầu, lưỡi, ngực, chân và có xuất huyết lấm tấm. Lách thường không sưng to.
4. Chẩn đoán:
4.1 Chẩn đoán lâm sàng:
Dựa trên các triệu chứng điển hình, bệnh tích đại thể, tiền sử bệnh trong đàn, tỷ lệ bệnh và chết bệnh, loài thú mẫn cảm, tuổi mắc bệnh... Do diễn biến nhanh của bệnh và bệnh tích tương tự với một số bệnh khác như nhiệt thán, ung khí thán, Leptospirosis thể cấp nên chẩn đoán chỉ có giá trị khi phân lập và xác định căn bệnh. Vi khuẩn P. multocida dễ phân lập từ máu tim, lách, gan và dễ gây bệnh cho thỏ, chuột bạch nhưng xác định serotyp cần phải có các phòng thí nghiệm với các chuyên gia thực hiện.
4.2 Kỹ thuật chẩn đoán phòng thí nghiệm:
4.2.1 Xác định căn bệnh:
Trong bệnh bại xuất huyết thì bại huyết là kết thúc chủ yếu. Cho nên các mẫu máu lấy trên thú bệnh trước khi chết không phải lúc nào cũng chứa P. multocida. Cũng thế, vi khuẩn không thường xuyên có trong chất tiết mũi của thú bệnh.
Máu lấy ở tim là thích hợp nhất nếu chỉ lấy máu trong vòng vài giờ sau khi chết. Nếu thú chết đã hơi lâu thì nên lấy một xương dài. Trường hợp không mổ khám sau khi chết thì có thể lấy máu ở tĩnh mạch cổ (jugular vein) bằng syringe. Mẫu cần được bảo quản trong nước đá và gói cẩn thận, tránh làm rách bao bì.
Các mẫu máu được phết lên lame và nhuộm Gram hoặc Leishmans hay xanh Methylen. Vi khuẩn bắt màu G -, trực khuẩn ngắn có dạng lưỡng cực. Không nên có kết luận chẩn đoán nếu chỉ dựa vào kết quả kiểm tra trên kính hiển vi.
Môi trường nuôi cấy thích hợp cho Pasteurella là casein-sucrose-yeast (CSY) agar có thêm 5% máu. Thành phần môi trường này gồm có casein hydrolysate 3g, sucrose 3g, yeast extract 5g, NaCl 5g, dipotassium hydrogen sulphate 3g, nước cất vừa đủ 1 lít. pH được chỉnh 7,3-7,4 và môi trường được hấp tiệt trùng 1 bar, 15 phút. Sau đó 1,5% agar vô trùng được cho thêm vào. Khi để nguội đến 45-50 độ C, 5% máu bê (không có kháng thể chống P. multocida) được cho vào trước khi đổ ra đĩa Petri.
Các mẫu máu hoặc que bông thấm máu được cho vào 2-3 ml sinh lý mặn vô trùng trước khi được nuôi cấy. Trường hợp đối với xương dài, bề mặt xương được bôi cồn, đốt cháy mặt ngoài (đã vô trùng) và bẻ ra. Phần tủy xương được tách ra một cách vô trùng và được dùng nuôi cấy. Cấy trực tiếp thường chỉ thích hợp nếu bệnh phẩm còn tươi và chưa bị tạp nhiễm.
Nhằm xác định tính gây bệnh, người ta có thể tiêm máu hoặc tủy xương trộn với nước sinh lý mặn cho chuột (0,2 ml) S/C hoặc I/M. Chuột bạch được dùng để chứng tỏ ái lực đặc biệt của vi khuẩn. Chuột thường chết trong vòng 24-35 giờ. Trong máu ta có thể tìm thấy P. multocida thuần khiết, ngay cả khi bệnh phẩm đã hơi cũ. Vi khuẩn này được xác định qua đặc điểm hình thái và nuôi cấy, phản ứng sinh hóa và test huyết thanh học.
P. multocida tạo khuẩn lạc dạng láng (S), màu hơi xám nhưng trong, độ 1 mm đường kính trên môi trường thạch máu sau 24 giờ nuôi cấy ở 37 độ C. Khuẩn lạc trên môi trường CSY có kích thước lớn hơn. Trên môi trường nuôi cấy lâu, đặc biệt nếu không có máu thì khuẩn lạc sẽ nhỏ hơn. Nó không mọc trên Mc Conkey agar. Phết kính máu hoặc mô sẽ thấy các cầu trực khuẩn nhỏ, lưỡng cực, G-. Có thể thấy một số dạng biến hình có dạng sợi dài hơn. Lưỡng cực có thể thấy dễ hơn nếu nhuộm với Methylen blue hoặc Leishman.
Vi khuẩn này sinh oxydase, catalase và indole, khử nitrat. Nó không sản xuất urease hoặc sinh H2S, không sử dụng citrat hoặc làm tan chảy gelatin. Lên men glucose và sucrose tạo acid nhưng không sinh hơi. Đa số chủng vi khuẩn lên men sorbitol. Một số chủng lên men arabinose, xylose và maltose, trong khi salicin và lactose không bao giờ lên men.
4.2.2 Test huyết thanh học:
Nhiều phản ứng huyết thanh học được dùng để xác định các serotyp gây bại xuất huyết trâu bò. Thường dùng là phản ứng ngưng kết nhanh trên phiến kính (rapid slide agglutination test), phản ứng ngưng kết hồng cầu gián tiếp (indirect hemaglutination) nhằm định typ kháng nguyên giáp mô, một phản ứng ngưng kết dùng HCl xử lý tế bào để định kháng nguyên O và phản ứng miễn dịch khuếch tán trên agar .
Chế huyết thanh chuẩn: Các kháng huyết thanh chống vi khuẩn được điều chế từ thỏ. Canh trùng 6-8 giờ trên môi trường lỏng CSY được cấy lên môi trường thạch máu CSY. Sau nuôi cấy qua đêm (18-20 giờ) ta láng mặt thạch với nước sinh lý mặn có 0,3% formalin. Độ đục của huyễn dịch vi khuẩn được điều chỉnh theo ống Brown số 7. Thỏ được tiêm vào tĩnh mạch với khoảng cách 3-4 ngày với 0,2-0,5-1,0-1,5 và sau cùng 2 ml huyễn dịch xác vi khuẩn. Một tuần sau khi tiêm mũi cuối cùng, 0,5 ml huyễn dịch vi khuẩn sống có độ đặc tương ứng như trên được tiêm S/C hoặc I/M. Thỏ được lấy máu sau đó 10 ngày. Huyết thanh được bảo quản ở -20 độ C nhưng nếu sử dụng thường xuyên nên bảo quản ở 4 độ C có thêm Merthiolate 1:10 000.
4.2.2.1 Phản ứng ngưng kết nhanh trên phiến kính:
Dùng 1 khuẩn lạc vi khuẩn trộn với 1 giọt sinh lý mặn, thêm 1 giọt kháng huyết thanh và phiến kính được hơ nóng nhẹ. Trong vòng 30 giây sẽ có đám ngưng kết xuất hiện. Nếu môi trường để lâu thì các hạt ngưng kết sẽ mịn và cần thời gian lâu hơn.
4.2.2.2 Phản ứng ngưng kết hồng cầu gián tiếp (capsular typing polysaccharides):
Đầu tiên người ta dùng hồng cầu người máu O nhưng gần đây dùng hồng cầu cừu. Việc chuẩn bị kháng nguyên như sau:
Canh trùng lỏng 6-8 giờ của chủng cường độc 6:B hoặc 6:E được cấy vào đĩa thạch máu CSY và nuôi cấy qua đêm ở 37 độ C. Thu hoạch sinh khối với 3 ml sinh lý mặn có 0,3% formol. Huyễn dịch này được hâm nóng ở 56 độ C -30 phút, ly tâm 3000 vòng/ phút trong 15 phút ở 4 độ C và chất dịch trong nổi lên trên được bảo quản ở -20 độ C . Trường hợp nếu không có máy ly tâm lạnh, nên ly tâm 1500 vòng/ phút trong 30 phút và ta thu được chất dịch nổi phía trên, đó là chất chiết kháng nguyên giáp mô.
Máu cừu được lấy một cách vô trùng với chất kháng đông, ly tâm 500 vòng / 10 phút. Hồng cầu được rửa 3 lần trong nước sinh lý vô trùng. Kháng huyết thanh (3 thể tích) được cho hấp phụ lên hồng cầu ( 1 thể tích) trong 2 giờ ở 37độ C với điều kiện thỉnh thoảng lắc. Hồng cầu (1 thể tích) được mẫn hóa với chất chiết kháng nguyên 15 thể tích trong 1 giờ ở 37độ C, lắc thường xuyên. Các hồng cầu đã mẫn hóa được tách ra bằng ly tâm, rửa 3 lần trong nước sinh lý vô trùng và được pha thành huyễn dịch 1% trong nước sinh lý mặn.
Phản ứng được thực hiện trong các ống nghiệm hoặc các vĩ có đục lỗ. 8 giọt sinh lý mặn và 2 giọt kháng huyết thanh đã bị bất hoạt được cho vào lỗ đầu tiên và 5 giọt nước muối sinh lý cho mỗi lỗ khác. Pha loãng huyết thanh được tiến hành bằng cách trộn và chuyển 5 giọt sang lỗ kế bên, lỗ cuối cùng không có huyết thanh dùng đối chứng. Ơ hàng thứ nhất, người ta cho 1 thể tích bằng nhau (5 giọt) huyễn dịch hồng cầu 1% đã mẫn hóa và ở hàng thứ hai người ta cũng cho hồng cầu 1% nhưng không mẫn hóa (đối chứng). Các vĩ này được lắc đều và để ở nhiệt độ phòng trong 2 giờ. Hiện tượng ngưng kết hồng cầu diễn ra cho thấy phản ứng dương tính, phản ứng âm tính thể hiện 1 nút nhỏ.
4.2.2.3 Xác định kháng nguyên thân O (lipopolysaccharides):
Kháng nguyên thân O (somatic antigen) được điều chế chủ yếu bởi phương pháp mô tả như sau: canh trùng 6-8 giờ được cấy vào thạch máu CSY và nuôi cấy qua đêm. Thu hoạch sinh khối bằng 2-3 ml sinh lý mặn có 0,3% formol cho mỗi đĩa Petri; ly tâm 3 000 vòng / 15 phút ở 4 độ C (hoặc tốc độ 1200 -1000 vòng / 30-45 phút ở nhiệt độ phòng). Cặn vi khuẩn được hòa vào 25 ml dịch HCl muối để tạo huyễn dịch có độ đục tương đương với ống Brown số 6. Dịch này được để qua đêm. Sau đó ly tâm bỏ phần chất lỏng ở trên và cặn tế bào được rửa liên tiếp trong PBS có pH 5,0, 6,0 và 7,0 theo thứ tự.
Sau cùng, một huyễn dịch xác tế bào vi khuẩn có độ đục tương ứng với ống Brown số 6 được chỉnh pH = 7,0. Các huyễn dịch có hiện tượng tự ngưng kết đều phải được loại bỏ.
Kháng huyết thanh được điều chế chống lại huyễn dịch chứa tế bào nguyên vẹn thuộc các serotyp 6:B (Châu Á), 6:E (Châu Phi) hoặc 11:B (Uc). Phản ứng ngưng kết được tiến hành trên 1 phiến kính với kháng nguyên cần tìm cũng với 3 loại kháng huyết thanh trên. Một ngưng kết tạo các hạt mịn cho thấy có phản ứng ngưng kết đặc hiệu cho kháng nguyên O. Cần thiết có đối chứng kháng nguyên chuẩn để phản ứng dễ đọc và đánh giá kết quả cho chính xác.
Khi có xảy ra ngưng kết một phần không đặc hiệu, cần pha loãng huyết thanh 10 lần để cho phản ứng với kháng nguyên cần tìm và kháng nguyên chuẩn để xác định kháng nguyên thân O.
4.2.2.4 Phản ứng miễn dịch khuếch tán trên thạch (AGID):
Phản ứng này được áp dụng cho định typ kháng nguyên capsule cũng như cho định typ O, là tùy theo kháng nguyên và kháng thể được sử dụng. Kỹ thuật khuếch tán kép được sử dụng. Các lỗ được đục trên agar với 1 ở giữa và 6 lỗ chung quanh.
Xác định typ K: Môi trường chứa 1% Noble agar (Difco) hoặc loại tương đương, trong đó chứa 0,2 M dung dịch đệm phosphat và Merthiolate 1:10 000. Kháng nguyên và kháng thể cũng giống như ở phản ứng ngưng kết hồng cầu gián tiếp. Huyết thanh chuẩn được cho vào lỗ ở giữa, các kháng nguyên cần tìm được cho vào các lỗ chung quanh và phải có kháng nguyên chuẩn để đối chứng.
Xác định typ O: Môi trường gồm có 0,9% agar Noble (Difco) hoặc loại tương đương trong dung dịch NaCl 8,5‰. Để chuẩn bị kháng nguyên, sinh khối vi khuẩn ở mỗi đĩa Petri được thu hoạch với 1 ml dung dịch NaCl 8,5‰ có chứa 0,3% formol. Huyễn dịch này được đun nóng 100 độ C / 1 giờ. Cặn xác tế bào được loại bằng cách ly tâm và huyễn dịch ở trên được dùng làm kháng nguyên.
Kháng huyết thanh được điều chế trên gà. Bacterin (1 ml) được tiêm dưới da cổ của gà (lứa tuổi 12-16 tuần tuổi). Gà được lấy máu sau đó 3 tuần để chiết lấy huyết thanh.
4.2.2.5 Xác định serotyp:
Nói chung, có 2 hệ thống xác định typ đều được công nhận. Hệ thống thứ nhất là định typ kháng nguyên K bằng phản ứng ngưng hồng cầu của Carter hoặc trên agar (miễn dịch khuếch tán kép).
Hệ thống thứ 2 là định typ O bởi phương pháp của Namioka vàMurata, và bởi phương pháp của Heddleston, Gallagher và Rebers. Thường người ta chấp nhận việc xác định serotyp phải phối hợp kháng nguyên O và kháng nguyên K. Hai hệ thống dùng phổ biến là Namioka-Carter và Carter-Heddleston.
Trong hệ thống thứ nhất, các serotyp gây bại xuất huyết ở Á châu và Phi châu được ký hiệu là 6:B và 6:E theo thứ tự, trong khi ở hệ thống thứ nhì nó lại có ký hiệu B:2 và E:2 theo thứ tự.
5. Điều trị và phòng bệnh:
Pasteurella mẫn cảm in vitro đối với một số chất kháng sinh như Oxytetracycline, Chloramphenicol, Penicilline, Streptomycine hoặc các chất diệt khuẩn khác như Flumequine, phối hợp Trimethoprime và Sulfonamide.
 Tuy nhiên do bệnh diễn biến rất nhanh nên chỉ có kết quả nếu điều trị thật sớm. Ngay cả khi không còn tìm thấy vi khuẩn, thú vẫn có thể chết do trúng độc huyết (toxemia) (theo Jubb và ctv, 1985).
Tuy nhiên do bệnh diễn biến rất nhanh nên chỉ có kết quả nếu điều trị thật sớm. Ngay cả khi không còn tìm thấy vi khuẩn, thú vẫn có thể chết do trúng độc huyết (toxemia) (theo Jubb và ctv, 1985).
Biện pháp duy nhất có hiệu quả trong kiểm soát bệnh là tiêm vaccin cho các đàn thú có nguy cơ.
Có 3 loại vaccin được sản xuất và sử dụng là bacterin, vaccin keo phèn (alum precipitated vaccine) và vaccin nhũ hóa trong dầu (oil adjuvant vaccine). Vaccin chết nhũ hóa bao gồm paraffin và lanoline cho tác động bảo hộ tốt nhất, đồng thời có giá trị làm giảm thiệt hại nếu dùng khi có dịch xảy ra.
Receive articles via Email!