Bệnh Cúm Gia Cầm ( Avian Influenza - OIE)
Nguồn: http://www.oie.int/
Người dịch: Đặng Nguyên Bình
TÓM TẮT
Bệnh cúm gia cầm (AI) là do các virus thuộc thành viên của họ Orthomyxoviridae và được xếp vào giống virus cúm A (influenzavirus A). Ở đây có ba giống virus cúm – A, B và C; chỉ các virus cúm A mới gây bệnh cho các loài chim. Các chẩn đoán là bằng phân lập hay phát hiện và phân loại cho virus. Việc phân loại là do bệnh nhiễm trên các loài chim cho ra các dấu hiệu lâm sàng biến thiên rộng mà có thể khác nhau theo ký chủ, dòng virus, tình trạng miễn dịch của ký chủ, sự hiện diện của mọi vi sinh vật phụ nhiễm gây biến chứng và các điều kiện môi trường.
Nhận diện tác nhân gây bệnh: Các huyễn dịch mẫu pha chất kháng sinh lấy từ hầu họng (oropharyngeal) và các mẫu quét tăm bông (swab) lỗ huyệt hay phân lấy từ chim sống, hay phân và các mẫu gom của nội tạng từ chim chết, được đem cấy vào xoang ối (allantoic cavity) của phôi trứng vịt ấp 9-11 ngày. Các trứng này được ủ ở 35-37oC trong 4-7 ngày. Dịch xoang ối của tất cả trứng chứa phôi chết hay hấp hối trong quá trình ủ trứng và của tất cả trứng vào cuối thời gian ủ được đem xét nghiệm phát hiện tác động ngưng kết hồng cầu (haemagglutination activity). Sự hiện diện của virus cúm A có thể xác nhận được bằng xét nghiệm khuyếch tán miễn dịch (immunodiffusion) giữa hàm lượng virus với kháng huyết thanh kháng với các kháng nguyên vỏ bao virus (nucleocapsid) và/hoặc các kháng nguyên sinh chất của virus (matrix antigens), cả hai dạng kháng nguyên này đều thường có ở tất cả các virus cúm A. Việc phân lập trong phôi trứng gần đây đã được thay thế trong một số điều kiện, bằng phản ứng chuỗi phân tử sử dụng enzyme giả mã đảo ngược (reverse-transcription polymerase chain reaction – RT-PCR).
Để phân loại cho các phân chủng (subtype) virus, phòng thí nghiệm phải có kháng huyết thanh đơn giá đặc hiệu (monospecific antisera) được chế tạo kháng với các kháng nguyên phân lập của từng 16 haemagglutinin (tác nhân ngưng kết hồng cầu) (H1-H16) và 9 neuraminidase (tác nhân có phản ứng enzyme trung hòa) (N1-N9), của các phân chủng (subtypes) virus cúm A mà sẽ đem sử dụng trong các xét nghiệm khuyếch tán miễn dịch. Cách khác, virus mới phân lập được có thể được kiểm tra bằng các xét nghiệm ngưng kết hồng cầu (haemagglutination test) và ức chế enzyme trung hòa (neuraminidase inhibition) trên một bộ kháng huyết thanh đa giá kháng với một loạt các dòng virus bao trùm tất cả các phân chủng.
Theo từ ngữ cúm gia cầm độc lực cao (highly pathogenic avian influenza) và trước kia gọi là “bệnh toi gà – fowl plague”, ám chỉ bệnh nhiễm do dòng độc lực của virus cúm A, điều cần thiết là xác định độc lực của dòng phân lập này đối với gia cầm. Mọi dòng phân lập (isolate) của virus cúm có khả năng gây bệnh cao được xếp loại vào virus cúm gia cầm phải khai báo (notifiable avian influenza – NAI). Mặc dù tất cả các dòng virus độc lực phân lập được hiện nay đều hoặc là thuộc phân chủng H5 hay H7, nhưng hầu hết các dòng phân lập H5 hay H7 đều là độc lực thấp. Do nguy cơ về một dòng độc lực thấp của H5 hay H7 trở nên độc lực bằng biến dị (mutation) trên các ký chủ gia cầm, tất cả virus H5 và H7 đều được xếp loại là các virus NAI. Các phương pháp áp dụng cho xác định một dòng độc lực đối với các loài chim đã thực hiện trong những năm gần đây với nhiều hiểu biết về cơ sở phân tử của khả năng gây bệnh, nhưng chủ yếu vẫn là nuôi cấy trên một nhóm tối thiểu tám con gà 4-8 tuần tuổi có mẫn cảm với virus; các dòng virus được coi là có khả năng gây bệnh cao nếu chúng gây ra tỷ lệ tử vong trên 75% trong vòng 10 ngày, hay có chỉ số gây bệnh qua đường mạch máu (intravenous pathogenicity index – IVPI) lớn hơn 1,2. Việc phân loại các dòng nghi ngờ có độc lực sẽ được thực hiện trong phòng thí nghiệm an toàn về virus. Tất cả các dòng phân lập có độc lực của virus AI đều được nhận diện là các virus cúm gia cầm có khả năng gây bệnh cao phải khai báo (highly pathogenic notifiable avian influenza – HPNAI). Bất kể độc lực đối với gia cầm, các virus H5 hay H7 mà có vị trí phân cắt HA0 ở kết chuỗi của amino acid giống với mọi virus mà đã quan sát thấy có độc lực, đều được coi là các virus HPNAI. Các dòng phân lập H5 và H7 mà không gây bệnh trên gia cầm và không có vị trí phân cắt HA0 trên kết chuỗi của amino acid này như quan sát thấy ở các virus thuộc HPNAI, đều được nhận diện là các virus cúm gia cầm phải khai báo có khả năng gây bệnh thấp (low pathogenicity notifiable avian influenza – LPNAI) và các dòng phân lập được không phải là H5 hay H7 mà không có khả năng cao về gây bệnh cho các loài chim đều được nhận diện là các virus cúm gia cầm có khả năng gây bệnh thấp (low pathogenicity avian influenza – LPAI).
Các xét nghiệm huyết thanh học: Do tất cả các virus cúm A có các kháng nguyên vỏ bao nucleocapsid và sinh chất matrix có tính kháng nguyên tương tự, các xét nghiệm khuyếch tán miễn dịch trên thạch (agar gel immunodiffusion tests) được áp dụng để phát hiện các kháng thể đối với các kháng nguyên này. Các chế phẩm cô đậm có chứa cả hai dạng kháng nguyên này được sử dụng trong các xét nghiệm này. Không phải tất cả các loài chim đều phát triển ra các kháng thể có khả năng chứng minh được kết tủa. Các xét nghiệm ức chế ngưng kết hồng cầu (haemagglutination inhibition tests – HI) cũng được áp dụng để làm thủ tục chẩn đoán huyết thanh học, nhưng kỹ thuật này có thể không phát hiện ra một số bệnh nhiễm đặc trưng do yếu tố ngưng kết hồng cầu là đặc trưng của phân chủng (subtype specific). Các xét nghiệm hấp phụ miễn dịch kết hợp enzyme đã được sử dụng để phát hiện các kháng thể đối với các kháng nguyên đặc hiệu với cúm A.
Các yêu cầu đối với vaccin và các chẩn đoán sinh học: Về lịch sử, trong hầu hết các quốc gia, các vaccin đặc biệt được thiết kế để chứa hay phòng ngừa HPNAI hiện này đã bị cấm hay không khuyến khích bởi các quan chức chính phủ, vì các vaccin này có thể cản trở chính sách kiểm soát tiêu hủy. Trong những năm 1990, việc áp dụng phòng ngừa các vaccin bất hoạt nhũ dầu đã thực hiện ở Mexico và Pakistan để kiểm soát sự lan tràn các ổ dịch NAI, và có một vaccin tái tổ hợp trên virus đậu gia cầm thể hiện gen HA tương đồng (recombinant fowl poxvirus vaccine expressing the homologous HA gene) cũng đã sử dụng ở Mexico, El Sanvado và Guatemala. Trong thời gian từ 1999-2001, trong một ổ dịch của LPNAI ở Ý, một vaccin bất hoạt đã được sử dụng có cùng dạng haemagglutinin như ở virus thực địa, nhưng khác neuraminidase. Điều này cho phép phân biệt giữa chim đã được cấp vaccin với chim nhiễm virus thực địa, và cuối cùng dẫn đến thanh toán được virus thực địa. Việc áp dụng phòng ngừa với các vaccin H5 và H7 đã được thực hiện trong một số vùng ở Ý, nhắm đến ngăn ngừa bệnh nhiễm LPNAI và một số quốc gia ở Đông Nam Á đã áp dụng vaccin phòng ngừa làm trợ giúp cho kiểm soát bệnh nhiễm virus H5N1 HPNAI. Các virus HPNAI sẽ không được sử dụng làm virus giống để chế tạo vaccin.
Nếu sử dụng virus HPNAI trong các nghiên cứu thử thách vaccin, điều kiện cơ sở vật chất phải hội đủ các yêu cầu cho Khu trú mầm bệnh Nhóm 4 (Containment Group 4 pathogens).
A. MỞ ĐẦU
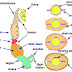
Bệnh cúm gia cầm phải khai báo (notifiable avian influenza – NAI) là do bị nhiễm virus thuộc họ Orthomyxoviridae nằm trong giống influenzavirus A. Các virus cúm A đều thuộc về các orthomyxovirus được biết là gây bệnh cho các loài chim. Nhiều loài chim đã thể hiện là có mẫn cảm với bệnh nhiễm do các virus cúm A; các loài chim thủy sinh (aquatic birds) hình thành nguồn tàng trữ chủ yếu cho những virus này, nhưng phần lớn các dòng phân lập được là có khả năng gây bệnh thấp đối với gà và gà tây. Các virus cúm A có các proteins vỏ bao nucleocapsid và proteins sinh chất matrix có tính kháng nguyên liên quan với nhau, nhưng được phân loại thành các phân chủng dựa vào các kháng nguyên haemagglutinin (H) và neuraminidase (N) của chúng (80). Hiện nay ghi nhận được 16 phân chủng H (H1 – H16) và 9 phân chủng N (N1 – N9). Cho đến nay, các virus cúm A độc lực cao (highly virulent influenza A virus) gây bệnh cấp tính cho gà, gà tây và các loài chim khác mà có tầm quan trọng về kinh tế chỉ gồm các phân chủng H5 và H7. Hầu hết các virus của phân chủng H5 và H7 được phân lập từ các loài chim đều có độc lực thấp đối với gà (2). Do nguy cơ virus H5 hay H7 có độc lực thấp trở nên có độc lực nhờ biến dị (mutation), tất cả các virus H5 và H7 đều phải coi là virus cúm gia cầm phải khai báo (notifiable avian influenza – NAI) (81).
Tùy theo loài, lứa tuổi và giống chim, đặc điểm đặc trưng của dòng virus gây bệnh, và các yếu tố môi trường, bệnh có khả năng gây nhiễm cao, trên các loài chim đầy đủ mẫn cảm, có thể khác nhau từ chết đột ngột với ít dấu hiệu lâm sàng hay không rõ ràng, đến bệnh đặc trưng hơn với các thể hiện lâm sàng khác nhau, bao gồm các dấu hiệu hô hấp, như xuất dịch mắt và mũi, ho, sặc và khó thở, sưng ở các xoang và/hoặc đầu, lờ đờ, giảm gáy, giảm ăn rõ rệt và các dấu hiệu thần kinh và tiêu chảy. Ở gà đẻ, các đặc trưng lâm sàng thêm vào bao gồm giảm rõ rệt trong sản xuất trứng, thường kèm theo gia tăng số lượng trứng chất lượng kém. Điển hình là tỷ lệ mắc bệnh cao kèm theo gia tăng nhanh chóng tỷ lệ tử vong không giải thích được. Tuy nhiên, không có dấu hiệu nào trong đó có thể được coi là sinh bệnh học (pathognomonic). Ngoài ra, các virus cúm gia cầm có khả năng gây bệnh thấp (low pathogenicity avian influenza – LPAI), bình thường chỉ gây bệnh nhẹ hay không thể hiện lâm sàng, có thể trong một số hoàn cảnh nào đó gây ra một loạt các dấu hiệu nặng nề mà có thể bằng với các dấu hiệu bệnh do virus cúm gia cầm có khả năng gây bệnh cao, đặc biệt là nếu có các bệnh nhiễm khác kèm theo. Do đó, các chẩn đoán xác nhận của bệnh tùy thuộc vào phân lập virus gây bệnh và chứng minh đầy đủ các tiêu chí được nêu trong đoạn B.2. Trong một số hoàn cảnh đặc biệt, việc này có thể thực hiện được bằng phát hiện virus trong ký chủ bị nhiễm; đặc biệt là áp dụng các kỹ thuật phân tử mà cho phép xác định độc lực của virus. Huyết thanh đem xét nghiệm của loài chim nghi ngờ bệnh, áp dụng các phương pháp huyết thanh học có thể chẩn đoán bổ sung, nhưng các phương pháp này không thích hợp cho một nhận diện chi tiết. Các chẩn đoán cho các mục đích kiểm soát chính thức được thiết lập dựa trên cơ sở tiêu chuẩn chính thức được chấp thuận đối với khả năng gây bệnh theo các xét nghiệm ở nội môi trường hay đối với các xác định phân tử (tức là sự hiện diện của các amino acid cơ bản có vị trí phân cắt HA0 của protein chỉ điểm) và phân chủng haemagglutinin. Các xác định này có liên quan đến hiểu biết khoa học về sự gia tăng của bệnh.
HPNAI và NAI đều phải chịu kiểm soát chính thức và các virus này có nguy cơ cao về phát tán từ phòng thí nghiệm; do đó, một đánh giá nguy cơ phải được thực hiện để xác định cấp độ của an toàn sinh học cần thiết cho các phòng thí nghiệm chẩn đoán và cấy truyền trên gà; việc phân loại virus phải được thực hiện (ít nhất là) ở khu trú sinh học cấp độ 3. Điều kiện cơ sở vật chất phải hội đủ yêu cầu của Nhóm khu trú (containment group) như đã xác định bởi đánh giá nguy cơ nêu ra trong Chương 1.1.2 An toàn sinh học và Bảo vệ sinh học trong phòng thí nghiệm vi sinh thú y và cơ sở nuôi nhốt động vật thí nghiệm. Các quốc gia mà không có phòng thí nghiệm chuyên môn thuộc quốc gia hay vùng thì sẽ gởi các mẫu đến Phòng thí nghiệm Tham chiếu của OIE.
B. CÁC KỸ THUẬT CHẨN ĐOÁN
1. Nhận diện tác nhân gây bệnh (xét nghiệm được mô tả cho giao thương quốc tế)
Các mẫu lấy từ chim chết phải bao gồm chất chứa trong ruột (phân) hay quét tăm bông lỗ huyệt và hầu họng. Các mẫu từ khí quản, phổi, các túi khí, ruột, lách, thận, não, gan và tim cũng được thu thập và xử lý riêng hay gom chung.
Các mẫu lấy từ chim sống phải bao gồm cả quét tăm bông hầu họng và lỗ huyệt. Để tránh gây hại cho chúng, việc quét tăm bông cho các con chim nhỏ dễ tổn thương sẽ thực hiện bằng loại tăm bông nhỏ đặc biệt, có sẵn trên thị trường. Khi không sẵn có loại tăm bông này, có thể thay bằng thu thập phân tươi.
Các mẫu phải được đặt trong đệm muối phosphat (isotonic phosphate buffered saline – PBS), pH 7,0 – 7,4 có chứa các chất kháng sinh hay đặt trong một dung dịch có chứa protein và các chất kháng sinh. Các chất kháng sinh có thể khác nhau theo các điều kiện địa phương, nhưng sẽ gồm, thí dụ, penicillin (2000 units/ml), streptomycin (2 mg/ml), gentamycin (50 µg/ml) và mycostatin (1000 units/ml) đối với các mẫu mô và các mẫu quét tăm bông hầu họng, nhưng các hàm lượng phải tăng gấp năm lần đối với các mẫu phân và mẫu quét tăm bông lỗ huyệt. Quan trọng là điều chỉnh lại pH của dung dịch từ 7,0 – 7,4 sau khi thêm vào các chất kháng sinh. Khuyến cáo rằng dung dịch dùng cho vận chuyển các mẫu quét tăm bông phải có chứa protein để ổn định virus (như huyễn dịch tim-não, huyết thanh bò đến 5% [v/v] hay albumen của bò – 0,5% [w/v]). Phân và mô xay mịn phải được xử lý thành huyễn dịch 10 – 20% (w/v) trong dung dịch có chất kháng sinh. Các huyễn dịch phải được xử lý càng sớm càng tốt sau khi ủ 1 – 2 giờ ở nhiệt độ phòng. Khi việc xử lý ngay là không thể thực hiện được, các mẫu có thể được bảo quản ở 4oC đến 4 ngày. Với bảo quản lâu dài, các mẫu dùng chẩn đoán và phân lập phải được bảo quản ở -80oC. Phải tránh lặp lại việc đông lạnh-giải đông đối với mẫu.
Phương pháp thích hợp cho nuôi cấy các virus cúm A là cấy vào phôi trứng gà sạch bệnh (specific pathogen free – SPF) hay trứng gà âm tính với kháng thể đặc hiệu (specific antibody negative – SAN). Dịch phù nổi của phân hay của huyễn dịch mô thu được qua gạn lọc bằng ly tâm ở 1.000 g, đem cấy vào túi ối của ít nhất năm phôi trứng gà SPF hay SAN đã ấp được 9 – 11 ngày. Các trứng cấy xong đem ủ ở 35 – 37oC trong 4 – 7 ngày. Các trứng chứa phôi chết hay hấp hối, và tất cả các trứng còn lại ở cuối giai đoạn ủ, đều được đem làm lạnh đến 4oC và chất dịch ối sau đó sẽ được đem xét nghiệm về phản ứng ngưng kết hồng cầu (haemagglutination – HA) (xem Đoạn B.3.b). Việc phát hiện phản ứng HA trong dịch xoang ối chứng tỏ khả năng cao về sự hiện diện của virus cúm A hay có paramyxovirus của loài chim. Các chất dịch mà cho ra phản ứng âm tính phải được đem cấy truyền thêm vào ít nhất một lô trứng, để xác nhận âm tính.
Sự hiện diện của virus cúm A có thể xác nhận trong xét nghiệm khuyếch tán miễn dịch trên thạch (agar gel immunodiffusion – AGID) bằng chứng minh sự hiện diện của các kháng nguyên vỏ bao nucleocapsid hay sinh chất, cả hai dạng kháng nguyên này đều thường có ở các virus cúm A (xem Đoạn B.3.a). Các kháng nguyên có thể được chuẩn bị bằng cô đậm virus từ dịch ối hay chiết xuất từ màng túi ối đã được gây nhiễm; các chất chứa kháng nguyên này được xét nghiệm bằng kháng huyết thanh đã biết dương tính. Virus có thể cô đậm từ dịch ối đã được gây nhiễm, bằng cách siêu ly tâm, hay bằng ngưng kết virus trong các môi trường acid. Phương pháp ngưng kết virus gồm cho HCl 1,0 M vào dịch ối cho đến khi dịch ối có pH khoảng 4,0. Hỗn hợp này được đặt vào bồn nước đá trong 1 giờ và sau đó đem gạn lọc bằng cách ly tâm ở 1.000 g trong 4oC. Dịch phù nổi đem gạn bỏ. Virus cô đậm này được tái hòa tan trong dịch đệm glycin/sarcosyl; dịch này gồm 1% (w/v) sodium lauroyl sarcosinate, được đệm đến pH 9,0 với glycine 0,5 M. Dịch chất này chứa cả kháng nguyên vỏ bao nucleocapsid và sinh chất matrix của virus.
Các chế phẩm kháng nguyên giàu nucleocapsid cũng có thể thu được từ các màng túi ối để sử dụng cho xét nghiệm AGID (7). Phương pháp này bao gồm lấy ra màng túi ối từ trứng đã được gây nhiễm mà có dịch ối có phản ứng HA. Các màng này sau đó được đem tạo huyễn dịch hay nghiền mịn. Dịch chất thu được đem đông lạnh-giải đông trong ba chu kỳ, sau đó đem ly tâm ở 1.000 g trong 10 phút. Phần trầm lắng không sử dụng, dịch phù nổi được sử dụng làm kháng nguyên sau khi xử lý với formalin 0,1%.
Việc áp dụng xét nghiệm AGID để chứng minh các kháng nguyên vỏ bao nucleocapsid hay sinh chất matrix là phương cách đảm bảo để chỉ ra sự hiện diện của virus cúm gia cầm trong dịch ối, nhưng nhiều dạng xét nghiệm hấp phụ miễn dịch kết hợp enzyme (enzyme-linked immunosorbent assays – ELISA) cũng hiện hành. Ở đây có xét nghiệm ELISA có độ nhạy và tính đặc hiệu chứng minh được nucleoprotein của virus cúm A, sử dụng kháng thể đơn giá kháng với nucleoprotein của virus cúm A (47, 49, 64). Xét nghiệm này sẵn có bộ kit thương mại.
Mọi phản ứng HA của các chất dịch vô trùng thu thập được từ các trứng đã cấy truyền, thì thường là do virus cúm A hay do paramyxovirus của loài chim (một số dòng của reovirus cũng có phản ứng này, hay do dịch chất không vô trùng có chứa yếu tố ngưng kết hồng cầu sinh ra từ vi khuẩn). Ở đây ghi nhận có chín chủng huyết thanh hiện tại của các paramyxovirus trên loài chim. Hầu hết các phòng thí nghiệm sẽ có kháng huyết thanh đặc hiệu cho virus bệnh Tân thành (Newcastle virus) (là avian paramyxovirus type 1), và trên quan điểm bệnh xảy ra rộng khắp và hầu hết đều sử dụng vaccin sống trên gà, nên kháng huyết thanh này tốt nhất cho đánh giá sự hiện diện của virus bệnh Tân thành bằng các xét nghiệm ức chế ngưng kết hồng cầu (haemagglutination inhibition tests – HI) (xem Chương Bệnh Tân thành – Newcastle disease).
Cách khác, sự hiện diện của virus cúm có thể xác nhận được bằng áp dụng phản ứng chuỗi phân tử sử dụng enzyme giải mã đảo ngược (reverse-transcription polymerase chain reaction – RT-PCR), trong đó có các đoạn mồi dành riêng mã hóa cho nucleoprotein đặc hiệu hay sinh chất matrix đặc hiệu (3, 53). Cũng vậy, sự hiện diện của phân chủng virus cúm H5 hay H7 có thể xác nhận được bằng sử dụng các đoạn mồi đặc hiệu với H5 hay H7 (21, 46, 53, 79).
Phương pháp được khuyến cáo cho xác định phân chủng kháng nguyên của virus cúm A bởi Ủy ban Chuyên gia thuộc Tổ chức Y tế Thế giới (World Health Organization (WHO) Expert Committee) (80), bao gồm sử dụng kháng huyết thanh đặc hiệu cao được chế tạo trong thú vật mà chỉ cho ra tối thiểu các phản ứng không đặc hiệu (như dê), kháng trực tiếp với các phân chủng H và N (45). Một kỹ thuật khác là sử dụng kháng huyết thanh đa giá sinh ra để kháng với một loạt virus cúm còn nguyên vẹn. Việc nhận biết phân chủng virus bởi kỹ thuật này là nằm ngoài phạn vi của hầu hết các phòng thí nghiệm không chuyên biệt với các virus cúm. Các trợ giúp là sẵn có từ các Phòng thí nghiệm Tham khảo của OIE (xem Bảng nêu ở Phần 3 của Hướng dẫn này).
2. Đánh giá khả năng gây bệnh
Từ ngữ cúm gia cầm có khả năng gây bệnh cao (highly pathogenic avian influenza) ám chỉ đến đánh giá về độc lực trên gà và ám chỉ đến sự tham gia của các dòng virus độc lực. Từ ngữ này dùng để mô tả bệnh trên gà có đầy đủ mẫn cảm với các dấu hiệu lâm sàng như xuất dịch mắt và mũi, ho, hắt hơi và khó thở, sưng phù các xoang và/hoặc đầu, lờ đờ, giảm gáy, giảm rõ rệt mức độ ăn uống, tím tái vùng da không có lông, mào và yếm, loạng choạng và các dấu hiệu thần kinh, và tiêu chảy. Ở gà đẻ có thêm đặc trưng lâm sàng bao gồm giảm đẻ rõ rệt, thường kèm theo gia tăng số lượng trứng kém chất lượng. Điển hình là tỷ lệ mắc bệnh kèm theo tỷ lệ tử vong cao và gia tăng nhanh chóng không giải thích được. Tuy nhiên, không dấu hiệu nào có thể được coi là sinh bệnh học (pathognomonic) và tỷ lệ tử vong cao có thể diễn ra mà không có dấu hiệu nào. Ngoài ra, các virus cúm gia cầm có khả năng gây bệnh thấp (low phathogenicity avian influenza – LPAI) bình thường chỉ gây bệnh lâm sàng nhẹ hay không triệu chứng, lại có thể gây thành bệnh nặng nề hơn nếu có mặt các bệnh nhiễm khác hay có các yếu tố môi trường bất lợi, và trong một số hoàn cảnh, mức độ của các dấu hiệu lâm sàng có thể giống như cúm gia cầm có khả năng gây bệnh cao (highly pathogenic avian influenza – HPAI). Ở Hội nghị Quốc tế Chuyên đề về Cúm Gia cầm năm 1981 (5), người ta đã thống nhất bỏ từ ngữ “dịch toi gà – fowl plague” và để định nghĩa về các dòng cúm gia cầm có khả năng gây bệnh cao là dựa vào khả năng của virus gây ra tỷ lệ tử vong không dưới 75% trong vòng 8 ngày trong ít nhất tám con gà mẫn cảm 4 – 8 tuần tuổi được cấy virus theo đường cơ bắp, vào mạch máu hay đường túi khí. Tuy nhiên, định nghĩa này chứng tỏ không hoàn thiện khi áp dụng đối với các virus chịu trách nhiệm cho các ổ dịch lan tràn trên gà xảy ra vào năm 1983 ở Pensylvania và các bang xung quanh ở nước Mỹ. Vấn đề chủ yếu là sự hiện diện của một virus có khả năng chứng minh rằng gây bệnh thấp trong các thử nghiệm phòng thí nghiệm, nhưng đã thể hiện đầy đủ khả năng gây bệnh sau khi thể hiện biến dị chỉ ở một điểm. Việc cân nhắc thêm về một định nghĩa để bao gồm các virus có “khả năng gây bệnh – potentially pathogenic” này đã được thực hiện bởi một số nhóm khoa học quốc tế.
Sưu tầm: Vetshop VN
Receive articles via Email!