Tổng Quan Kỹ Thuật PCR (Polymerase Chain Reaction)
Phương pháp PCR (Polymerase Chain Reaction) được Kary Mullis và cộng sự (Mỹ) phát minh năm 1985 và kể từ đó đã tạo nên một tác động to lớn đối với các nghiên cứu sinh học trên toàn thế giới. Ý tưởng của Mullis là phát triển một quy trình mà DNA có thể nhân lên nhiều lần một cách nhân tạo qua nhiều chu kỳ sao chép bởi enzyme DNA polymerase.
DNA polymerase hiện diện tự nhiên trong sinh vật sống, thực hiện chức năng nhân bản DNA khi tế bào phân chia. Enzyme này làm việc bằng cách liên kết với sợi DNA mạch đơn và tạo mạch DNA bổ sung. Theo quy trình PCR gốc của Mullis, enzyme phản ứng nhân bản DNA được thực hiện trong ống nghiệm (in vitro). Sợi DNA đôi bị tách thành 2 sợi đơn khi đun nóng ở 96°C, sau đó sự tổng hợp mach đôi của DNA sẽ xảy ra nhờ họat tính của enzyme DNA polymerase. Tuy nhiên, ở nhiệt độ cao, DNA polymerase bị phá hủy, vì vậy cần bổ sung enzyme sau mỗi giai đoạn nung nóng của mỗi chu kỳ. Quy trình PCR gốc của Mullis không có hiệu quả cao vì nó mất nhiều thời gian, cần một lượng lớn DNA polymerase, và liên tục phải lưu ý trong suốt quá trình PCR. Sau đó, quy trình gốc này được phát triển hơn với sự ứng dụng DNA polymerase lấy từ vi khuẩn ưa nhiệt (Thermophilic bacteria) sống trong mạch nước nóng ở nhiệt độ trên 110°C. DNA polymerase từ sinh vật này ổn định ở nhiệt độ cao và khi dùng trong PCR nó không bị phá hủy khi hỗn hợp được nung nóng để tách sợi DNA. Từ đó, không cần phải thêm DNA polymerase vào mỗi chu kỳ, quá trình sao chép DNA có thể đơn giản và tự động hơn. Một trong những DNA polymerase chịu nhiệt đầu tiên được phân lập được từ Thermus aquaticus và được gọi là Taq. Taq polymerase là enzyme được dùng rộng rãi trong thực nghiệm PCR.
2. NGUYÊN TẮC
Đây là phản ứng tổng hợp phân tử DNA bằng enzyme DNA polymerase chịu nhiệt (thường là Taq polymerase). Các DNA polymerase chỉ có thể tổng hợp được mạch DNA mới từ mạch khuôn bằng cách kéo dài một mồi (primer) là một trình tự nucleotide ngắn đã bắt cặp sẵn trên mạch khuôn.
PCR là một chuỗi phản ứng nhiều chu kỳ nối tiếp nhau, mỗi chu kỳ gồm ba giai đoạn:
- Giai đoạn biến tính: tách chuỗi DNA từ mạch đôi thành dạng mạch đơn
- Giai đoạn bắt cặp: gắn cặp mồi đặc trưng theo nguyên tắc bổ sung
- Giai đoạn kéo dài chuỗi: tổng hợp chuỗi DNA mới giống DNA gốc
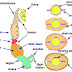
.jpg) |
| Hình 1: Sơ đồ phản ứng PCR |
Bằng cách sử dụng DNA polymerase bền với nhiệt độ (Taq polymerase), trộn lẫn với DNA khuôn và các tiền chất deoxynucleotide, mồi, sau đó hỗn hợp này được đưa vào chu trình nhiệt thích hợp với các giai đọan: tách chuỗi, liên kết mồi và tổng hợp chuỗi bổ sung. Trong vòng 60 phút, sự nhân bản có thể lên đến 1 triệu lần. DNA nhân bản sẽ dễ dàng được phát hiện bằng các phương pháp khác nhau, thông thường nhất là điện di trên gel agarose với phẩm nhuộm ethidium bromide.
.jpg) |
| Hình 2: Điện di trên gel agarose và nhuộm bằng ethidium bromide để phát hiện DNA nhân bản bằng PCR |
3. THÀNH PHẦN PHẢN ỨNG PCR
Trình tự DNA cần nhân bản
Chúng có thể là đoạn acid nucleic đặc trưng của vi khuẩn gây bệnh, của gene bệnh lý, của dấu ấn di truyền… mà phản ứng PCR sẽ nhân bản lên (gia tăng số lượng) để chúng có thể được phát hiện dễ dàng. Phản ứng PCR sẽ không xảy ra được nếu bệnh phẩm không có nucleic acid đích hoặc trong bệnh phẩm còn các chất ức chế phản ứng PCR (SDS, hemoglobin, sắc tố, heparin…). Trong những trường hợp này kết quả PCR sẽ âm tính nhưng là âm tính giả. Vì vậy, vấn đề chuẩn bị mẫu bệnh phẩm cho thử nghiệm PCR phải được coi trọng, đặc biệt là trong các phòng thí nghiệm áp dụng PCR để chẩn đoán phát hiện bệnh.
Đoạn mồi (Primer)
Là những đoạn DNA đơn (oligonucleotide) có kích thước chỉ vài chục base (18-30), có thể bắt cặp theo nguyên tắc bổ sung (A-T, G-C) vào đoạn khởi đầu và kết thúc của chuỗi DNA đích khi chuỗi đích này được biến tính thành sợi đơn. Trong thử nghiệm PCR, đoạn mồi có hai vai trò chính:
- Quyết định nên tính đặc hiệu của phản ứng PCR, vì nếu đoạn mồi được chọn càng đặc hiệu cho chuỗi đích thì sản phẩm PCR càng đặc hiệu và phản ứng PCR càng đặc hiệu.
- Khởi động enzyme polymerase vì enzyme polymerase chỉ có thể bắt đầu tổng hợp sợi bổ sung cho chuỗi đích khi nó nhận dạng được đầu 3’ (là đầu mà nó xúc tác cho một dNTP được gắn vào) đang ở tình trạng sợi đôi.
dNTP (deoxy nucleoside triphosphate)
Đơn vị để có thể tổng hợp được các bản sao của DNA đích. dNTP có cấu tạo gồm một đường deoxyribose có gắn một base, có thể là adenine (dATP), hay thymine (dTTP), hay cytosine (dCTP), hay guanine (dGTP) ở carbone số 1 (C1). Ba phân tử phosphate (triphosphate) được gắn tại carbone số 5 (C5) của phân tử deoxyribose này và đây chính là nơi mà dNTP gắn vào đầu 3’ của chuỗi bổ sung trên chuỗi đích. Năng lượng để phản ứng này xảy ra được lấy từ các nối phosphate giàu năng lượng của triphosphate trên dNTP.
Enzyme DNA polymerase chịu nhiệt
Taq-polymerase là DNA polymerase chịu nhiệt được sử dụng đầu tiên cho phản ứng PCR. Hiện nay, một số DNA polymerase chịu nhiệt khác cũng được sử dụng trong phản ứng PCR như Vent/deep vent DNA polymerase (Thermococcus litoralis), Pfu DNA polymerase (Pyrococcus furiosus), Tth DNA polymerase (Thermus thermophilus), UITma DNA polymerase (Thermotoga maritime)…
Dung dịch đệm cho phản ứng PCR
Thường chứa muối đệm Tris-HCl, KCl, MgCl2. Trong đó, MgCl2 ảnh hưởng đáng kể đến phản ứng PCR. MgCl2 cần cho hoạt động của Taq-polymerase, hàm lượng quá cao sẽ tạo nhiều sản phẩm ký sinh, quá thấp làm giảm hiệu quả nhân bản của enzyme. Nồng độ tối ưu phải được xác định cho từng phản ứng qua thử nghiệm.
Máy luân nhiệt
Quá trình PCR được thực hiện trong các buồng ủ của máy luân nhiệt. Máy luân nhiệt gồm các bộ phận chính:
- Một bàn phím đơn giản để lập các chương trình chu kì nhiệt và ra các mệnh lệnh để máy thực hiện.
- Một bộ vi xử lý để ghi nhớ các chương trình đã nạp vào máy, thực hiện các mệnh lệnh đến buồng ủ PCR, ghi nhận cách thay đổi nhiệt độ buồng ủ PCR trong các chu kỳ nhiệt để điều chỉnh cho đúng với chương trình đang được thực hiện.
- Buồng ủ PCR là nơi các chu kỳ nhiệt được thực hiện qua sự điều khiển của bộ vi xử lý.Trong các chu kỳ nhiệt, nhiệt độ trong buồng ủ PCR có thể đưa lên cao hay hạ xuống thấp trong một thời gian rất ngắn.
4. ỨNG DỤNG CỦA PHƯƠNG PHÁP PCR
Bằng kỹ thuật PCR, từ một lượng khuôn DNA rất nhỏ như: một giọt máu, một sợi tóc hay một tế bào… người ta có thể nhân bản chính xác, trật tự một lượng lớn lên đến hàng triệu bản nhằm phục vụ cho các quá trình khảo sát trong phản ứng. Trong công nghệ sinh học, PCR được sử dụng trong việc lập bản đồ gen, phát hiện gen, dòng hoá gen, giải mã trình tự DNA …
Trong vi sinh học, PCR là một phương tiện hữu dụng để phát hiện các tác nhân vi sinh vật gây bệnh trong các trường hợp:
- Tác nhân không thể nuôi cấy thường quy: như các virus (viêm gan B, viêm gan C, Dengue, HIV, Herpes, CMV, EBV, HPV, virus SARS, H5N1…), các vi khuẩn (Chlamydia, Legionella, Mycoplasma,Treponema pallidum…).
- Tác nhân nuôi cấy thường quy cho kết quả chậm: M. tuberculosis.
- Tác nhân nuôi cấy thất bại vì có mặt rất ít trong bệnh phẩm, đã được điều trị kháng sinh trước đó (lao thất bại nuôi cấy, viêm màng não mủ …).
PCR cũng được dùng để xác định độc tố của vi sinh vật: Độc tố ruột của vi khuẩn tả (CT - cholera toxin) đóng vai trò chủ đạo trong cơ chế gây bệnh của chúng. PCR đã được dùng khuyếch đại đoạn gen mã hoá cho CT; nhờ đó, có thể phân biệt một cách chắc chắn Vibrio cholerae gây bệnh tả thực sự với các Vibrio cholerae khác, thuộc các nhóm huyết thanh không gây bệnh tả (trước đây gọi là các Vibrio không ngưng kết; nonagglutination, NAG).Clostridium difficile cũng được định loại (phân týp) thông qua xác định các loại độc tố riêng biệt của chúng bằng PCR.
Vi khuẩn trong dạ dày Helicobacter pylori (H.P) hiện đang là một trong những vấn đề thời sự của y học thế giới vì vai trò quan trọng của nó trong các bệnh lý viêm, loét và ung thư dạ dày được quan tâm gần đây. Tuy vậy, nuôi cấy HP rất khó, PCR đã được dùng để tìm HP trực tiếp từ mảnh sinh thiết dạ dày, hoặc tìm các gen (vacA, cagA) liên quan tới độc tính của nó. Nhờ PCR, người ta còn biết được sự phân bố của các chủng HP khác nhau trên các vùng địa lý khác nhau hoặc các chủng HP đặc biệt liên quan mật thiết đến những tình trạng bệnh lý nhất định.
PCR còn được dùng để nghiên cứu về tính kháng thuốc của vi khuẩn. Từ trước đến nay, tính kháng thuốc của vi khuẩn gây bệnh được xác định bằng các kỹ thuật dựa trên nuôi cấy như kháng sinh đồ theo Kirby Bauer (khuếch tán trên thạch) và xác định nồng độ ức chế tối thiểu (MIC - Minimal Inhibitory Concentration). Các kỹ thuật này chiếm nhiều thời gian nên khó cho phép có định hướng điều trị kịp thời trong các bệnh nhiễm khuẩn cấp. Ngoài ra, các kỹ thuật nuôi cấy có hiệu quả phục vụ điều trị không cao đối với một số vi sinh vật, như Mycobacterium tuberculosis, có thời gian tăng trưởng rất dài (nhiều tuần lễ). Với kỹ thuật PCR, người ta có thể phát hiện nhanh tính kháng thuốc của các chủng vi khuẩn gây bệnh. Ví dụ, PCR để xác định các đột biến kháng Rifamicin (dấu hiệu rất có giá trị để xác định một M. tuberculosis là đa đề kháng) ở gen rpoB. Nhờ vậy, những biện pháp điều trị phù hợp được áp dụng một cách kịp thời; điều đó mang lại lợi ích không nhỏ cho bệnh nhân và cộng đồng, vì rằng những chủng vi khuẩn lao đa đề kháng đã được hạn chế tung ra môi trường bên ngoài.
TÀI LIỆU THAM KHẢO
[1] Lê Văn Phủng. Một số ứng dụng của PCR trong vi sinh vật y học. Trường Đại học y Hà Nội.
[2] Hoàng Minh (2001), «Một số kỹ thuật sinh học phân tử hoá sinh và vi sinh trong chẩn đoán bệnh lao». Tạp chí Thông tin y dược, số 12, tháng 12 năm 2001.
[3] Richard Frothingham (1996). Applications of the polymerase chain reaction to infectious disease diagnosis. Ann Saudi Med 1996, p. 657 - 665.
[4] Tanil K., et al (1993). Detection of Mycobacterium tuberculosis in Sputum Samples by Polymerase Chain Reaction Using a Simplified Procedure. Journal of clinical microbiology, June 1993, p. 1435-1438.
[5] Johnson R., et al (2006), Drug resistance in Mycobacterium tuberculosis. Issues Mol. Biol. , p. 97-112.
[6] Stephanie AC, Robert JO, Louise T, Seth S (2001). PCR-Based Diagnosis of Helicobacter pylori Infection and Real-Time Determination of Clarithromycin Resistance Directly from Human Gastric Biopsy Samples. Journal of clinical microbiology, p. 1217–1220.
Receive articles via Email!